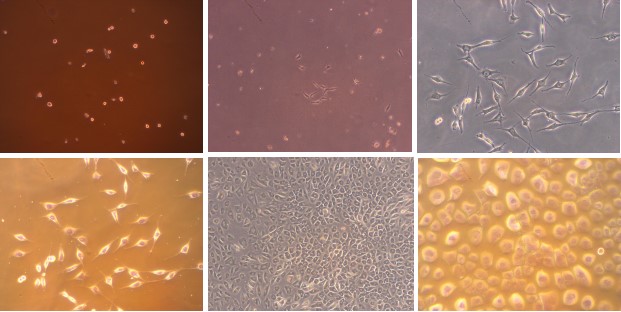
一、大鼠神经元细胞(酶消化法)
简述:新生24h或E18胎鼠,取脑,剥离海马,剪碎,木瓜酶消化,清洗过筛后铺于多聚赖氨酸包被的培养板中。

二、大鼠雪旺细胞(植块法)
简述:新生24h大鼠,取坐骨神经,剥去外膜和束膜,剪成1mm3的小块,均匀铺于培养皿内,加少量血清,37℃ CO2培养2h后,再加入培养基,24-48h后有细胞爬出。
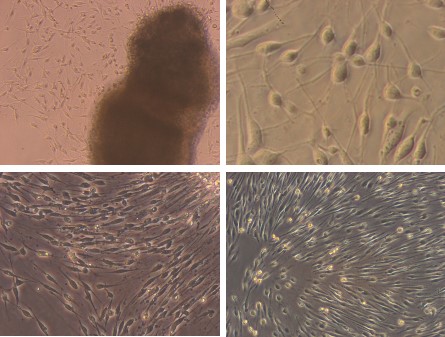
三、大鼠胰岛(酶消化加密度梯度离心)
简述:SD大鼠,常规麻醉、固定、消毒、进腹、胆总管插管,逆行注入预冷的1mg/ml胶原酶P溶液10ml。迅速取下胰腺,38℃水浴消化10分钟,600μm不锈钢网过滤,加入4℃新生牛血清和4℃Hank’s液终止消化。细胞悬液离心后,4℃ Hank’s液洗涤两次。沉淀物加25%Ficoll混匀,其上依次分别加入23%、20%、11%Ficoll溶液和Hank’s液,离心后吸出23%-20% 及20%-11%界面的胰岛,用4℃Hank’s液洗涤离心共三次。
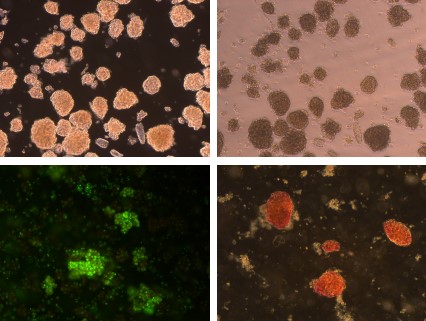
四、大鼠心脏窦房结细胞(酶消化法)
简述:大鼠心脏窦房结位于上腔静脉靠近右心房处的内壁上;取出生2-3day的新生大鼠,75%酒精浸泡后,固定于解剖板上,开胸,显微剪分离出上腔静脉及右心房一部,至于冷的HANKS缓冲液中,于解剖镜下观察搏动点,并剪去多余部分;之后将几只鼠的窦房结集中,剪碎后用0.5mg/ml II型胶原酶37℃消化20-30分钟,期间吹打数次,可分部收集消化下来的细胞。收集到的细胞加入10倍体积的PBS,1000rpm离心5分钟,弃上清,重复清洗一遍,沉淀中加入15%FBS的高糖DMEM培养基,重悬细胞,铺板,37℃,5%CO2 培养90分钟后,将未贴壁的细胞转移至新的培养皿中,继续培养,每天换液一次。
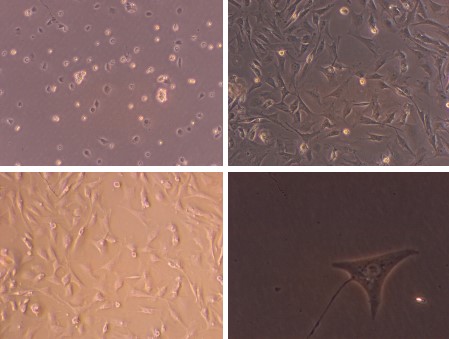
五、大鼠关节滑膜间质细胞(酶消化法)
简述:大鼠麻醉后,75%酒精消毒术区,于双侧膝关节关节腔取出滑膜组织,浸泡于含1%链霉素和青霉素的双抗H-DMEM中,低温下转移至超净工作台。使用含1 %双抗的PBS冲洗滑膜组织3次,用眼科剪将其剪成约1 mm×1 mm大小的组织块。加入10倍体积的0.4% Ⅰ型胶原酶,于37 ℃,体积分数5%CO2饱和湿度条件下进行4 h消化,待絮状物大部分消失后,100μm细胞筛过滤,吸取滤过液,1 200 r/min离心5 min,弃上清液,无菌PBS洗涤3次,用含体积分数10%胎牛血清的H-DMEM高糖培养基(含200 mmol/L谷氨酰胺,100 μmol/L抗坏血酸,100 U/mL青霉素,100 mg/L链霉素),以2×106/孔的细胞浓度接种于六孔板中,置37 ℃,体积分数5%CO2培养箱中培养。