干细胞 作为一种能够自我更新和分化的细胞类型,已经为世人熟知。自被发现起,干细胞就一直是研究热点。根据《 2016-2022 年中国干细胞医疗行业市场现状与行业前景调研分析报告》,2010 年干细胞产业市场规模为 215 亿美元,到 2015 年时已增至 635 亿美元。预测到 2020 年,干细胞市场规模达到 4000 亿美元。
作为在再生医学中使用的干细胞类型,间充质干细胞(MSC)有着巨大的市场价值空间且不断被看好。
如今,MSC 是临床试验中干细胞类型,也是科学文献中研究多的干细胞类型。
范围内其相关的临床试验超过 900 项,中国临床试验注册中心注册的 MSC 临床试验超过 104 项。这充分说明 MSC 治疗是世界范围内临床应用研究的热点,而我国在这一领域的发展也势头强劲。
MSC 几乎存在于我们体内的所有组织中,但常见于骨髓、脂肪组织、脐带组织、脐带血和胎盘。除了具有多功能性和分化成多种细胞谱系外,它们还能分泌多种细胞因子和生长因子,从而实现免疫调节,促进损伤愈合和组织再生。
MSC 非常适合细胞治疗的临床应用,因为它们具有多种谱系分化潜力。
它们可以在体外或体内分化成不同类型的功能细胞以代替老化或受损细胞。因为 MSC 的这些特性,其在 2020 年的治疗中也表现出了积极效果,病毒感染诱发机体内严重的炎症反应,炎性细胞因子增加、外周淋巴细胞减少、肺部损伤等,MSC 具有免疫调节能力和损伤修复功能,所以具有治疗的潜能。目前的初步临床结果显示间充质干细胞移植具有安全性和初步的有效性,能够为重症患者提供新的治疗工具。
当前,干细胞疗法处在技术到产品转化的过度阶段。那么如何在体外进行细胞规模化的高效扩增,是 MSC 应用中的关键。

传统扩增 MSC 的主要方式是采用方瓶、细胞工厂等进行 2D 贴壁培养,一个病人单次需要回输几个亿单位的细胞,那么就需要大量的 2D 培养容器以及操作人员;对于贴壁类型的细胞培养,如果想要规模化生产,微载体是不错的选择方式,新型的扩增 MSC 的方式是使用微载体以及波浪式反应器 WAVE,可以高效的进行干细胞的扩增,培养过程如下:
一、实验材料
细胞:间充质干细胞
培养方式:微载体 Cytodex 1 贴壁培养
培养基:无血清无外源蛋白成份明确间充质干细胞培养基(由原能细胞科技集团自主开发)
反应器:WAVE 25
二、实验步骤
1.
微载体的预处理
1.1 微载体处理:Cytodex 1 使用 DPBS 泡发 3 h。
1.2 使用 DPBS 洗涤 2 次 Cytodex 1,DPBS 浸泡后灭菌(121℃,30 min)。
1.3 Cytodex 1 冷却沉淀后,弃上清,安全柜内无血清培养基洗涤 2 次,定容。
2.
WAVE 的操作
2.1 无菌环境下拆开细胞袋,安装无菌空气滤器等配件。
2.2 将微载体培养液及细胞悬浮液依次从细胞袋输液管道输入。
2.3 将细胞袋固定在 WAVE 反应器托盘上,连接空气泵,设定温度 37 ± 0.5 度、泵压、反应器转速度和角度。
3.
MSC 细胞接种及培养过程
3.1 按 6000 cells/cm2接种新鲜 MSC 细胞至微载体培养液中(3 g/L)),孵育 30 min-1 h(间歇式摇匀)或者孵育过夜,调节转速至细胞不沉降聚集即可。
3.2 每隔一天从细胞袋无菌取样口用无菌注射器抽取 5 ml-10 ml 培养液进行镜检及支原体、内毒素等安全性质量检测。
3.3 培养 4-5 天,细胞长满。
4.
MSC细胞的收获
4.1 培养 4-5 天后将细胞微载体悬浮液从细胞袋出液管道输出至细胞收集瓶。
4.2 弃上清,DPBS 洗涤一遍,加入 Tryple 消化酶,温和摇匀消化 10 min-15 min。静置,待微载体沉降后,吸取细胞悬浮液。DPBS 再洗涤 2 遍,吸取细胞悬浮液。
4.3 离心 400×g,5 min。收集细胞,计数。
三、实验结果
1.
细胞生长情况
按0.6 × 104 cells/cm2接种新鲜MSC细胞至微载体培养液中(3g/L),4-5天后细胞可以长满Cytodex 1,每cm2可以生长2.5 × 104 MSC,细胞在Cytodex 1上的生长照片如下图1。
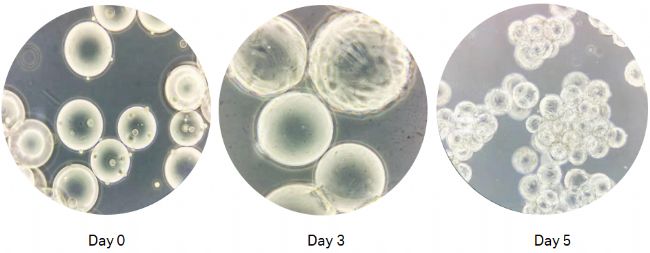
图 1. 微载体培养 MSC 生长图片
2.
流式细胞仪检测MSC细胞表面标记物
药典对 MSC 细胞表面标记物的检测要求是:CD73、CD90、CD105 ≥ 95%;CD11b、CD19、CD34、CD45、HLA-DR ≤ 2%。对上述培养的细胞进行检测,结果显示细胞表面标记物均满足要求并且阳性指标 CD73、CD90、CD105 、CD44 ≥ 98%,阴性指标 CD11b、CD19、CD34、CD45、HLA-DR 总和≤ 2%(数据未显示)。
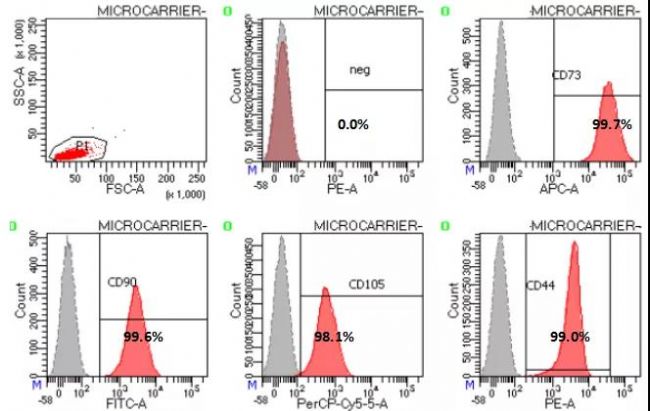
图2. 微载体培养MSC流式表型
3.
MSC 成脂和成骨分化
对 MSC 进行成脂和成骨诱导分化,油红 O 染色后显示成脂效果很好;茜素红 S 染色显示成骨效果很好。
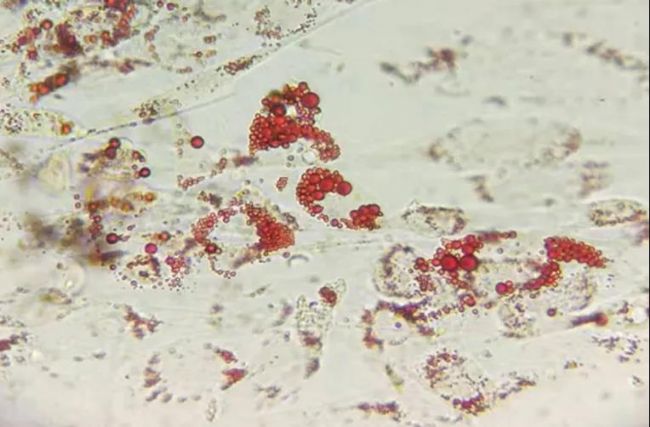
图3. 微载体培养MSC成脂分化
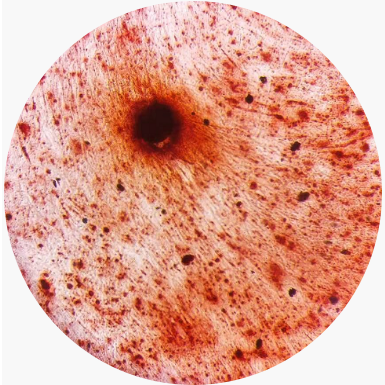
图4. 微载体培养MSC成骨分化
四、成本分析
以培养单人次回输细胞量 3.2×109 cells 为例,对比新型和传统扩增 MSC 方式的成本分析,主要从培养阶段的耗材成本和人员成本角度考虑,其中耗材成本如下图 5,使用 Cytodex 1 和 WAVE 的培养方式相较于 150 mm Dish 能够节约 14%,相较于 Hyper Flask 能够节约 190% 的耗材成本。人员成本角度列于表 1,使用 Cytodex 1 和 WAVE 的培养方式可以减少培养批次,从而降低批次间变异性,同时拥有合理的人员成本。

图5.不同培养方式耗材成本分析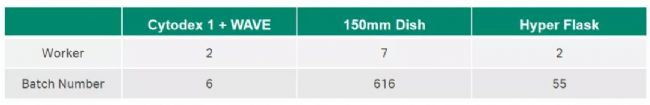
表1.不同培养方式人员成本分析及批次数